Anthony Hyman (2022):
Kondensate – Zelltröpfchen als biochemische Mini-Labore
Der britische Zellbiologe Anthony Hyman und sein Team entdeckten 2009 – bei Studien an einzelligen Embryonen eines Fadenwurms – einen völlig neuen Zustand biologischer Materie: In der Zellflüssigkeit können sich örtlich Proteine in hoher Konzentration ansammeln. Diese „Kondensate“ ähneln winzigen Tropfen, die unter anderem den Gesetzen der Biophysik unterliegen. Im Gegensatz zu anderen Zell-Organellen sind Kondensate nicht von einer begrenzenden Membran umgeben. Die stark erhöhte Proteinkonzentration in ihrem Innern regt biochemische Reaktionen an, die außerhalb nicht möglich wären. Kondensate bilden sich dynamisch, teils in Sekundenschnelle, und werden meist auch schnell wieder abgebaut. Bei – oft altersbedingten – Störungen des Abbaus können sich in betroffenen Zellen toxische Stoffe ablagern, die degenerative Krankheiten wie ALS oder Alzheimer auslösen. Hyman sucht nach neuen Medikamenten, die diese Krankheiten heilen könnten.
Kondensate – Zelltröpfchen als biochemische Mini-Labore
Text: Claus-Peter Sesín
Fotos: Friedrun Reinhold
Die Erforschung der Kondensate – angestoßen durch Hymans bahnbrechende Entdeckung im Jahr 2009 – steckt noch in den Anfängen, ist aber inzwischen das am schnellsten wachsende Pioniergebiet der Zellbiologie. Kondensate bergen den Schlüssel zu einigen der größten offenen Fragen dieses Fachgebiets. In weltweit hunderten Laboren versuchen Forschende, den Geheimnissen der komplexen Molekülinteraktionen in den Tröpfchen auf die Spur zu kommen. Auch die Pharmaforschung ist stark engagiert – in der Hoffnung, Kondensatbildung mittels Arzneien beeinflussen und Krankheiten wie Alzheimer oder Amyotrophe Lateralsklerose (ALS) kurieren zu können. Krankheitsursache sind in beiden Fällen zu toxischen Abscheidungen erstarrte Kondensate.
Anthony Hyman wurde in der israelischen Stadt Haifa geboren. Nach dem Studium der Zoologie am britischen University College, London, promovierte er 1987 am King’s College Cambridge über embryonale Zellteilungen des Fadenwurms Caenorhabditis elegans. Als Postdoc ging er an die University of California in San Francisco. 1993 wurde Hyman Gruppenleiter am Europäischen Laboratorium für Molekularbiologie in Heidelberg. 1999 war er eines der Gründungsmitglieder des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden, das er bis heute gemeinsam mit einem Direktor:innenteam leitet. Seit 2007 ist er Fellow der britischen Royal Society, seit 2020 internationales Mitglied der amerikanischen National Academy of Sciences sowie seit 2021 Mitglied der Nationalen Akademie der Wissenschaften Leopoldina.
Die wissenschaftliche Bedeutung der Kondensatforschung erklärt Hyman gern am Beispiel eines Dorfes: Die Dorfbewohner:innen arbeiten an unterschiedlichen Orten, etwa in der Bäckerei oder im Gemüseladen. In ähnlicher Weise sind Zellen organisiert. Proteine und RNA einer Zelle arbeiten in bestimmten Zellbereichen zusammen, darunter den Kondensaten, und erfüllen dort unterschiedliche Funktionen.
Abbildungen:
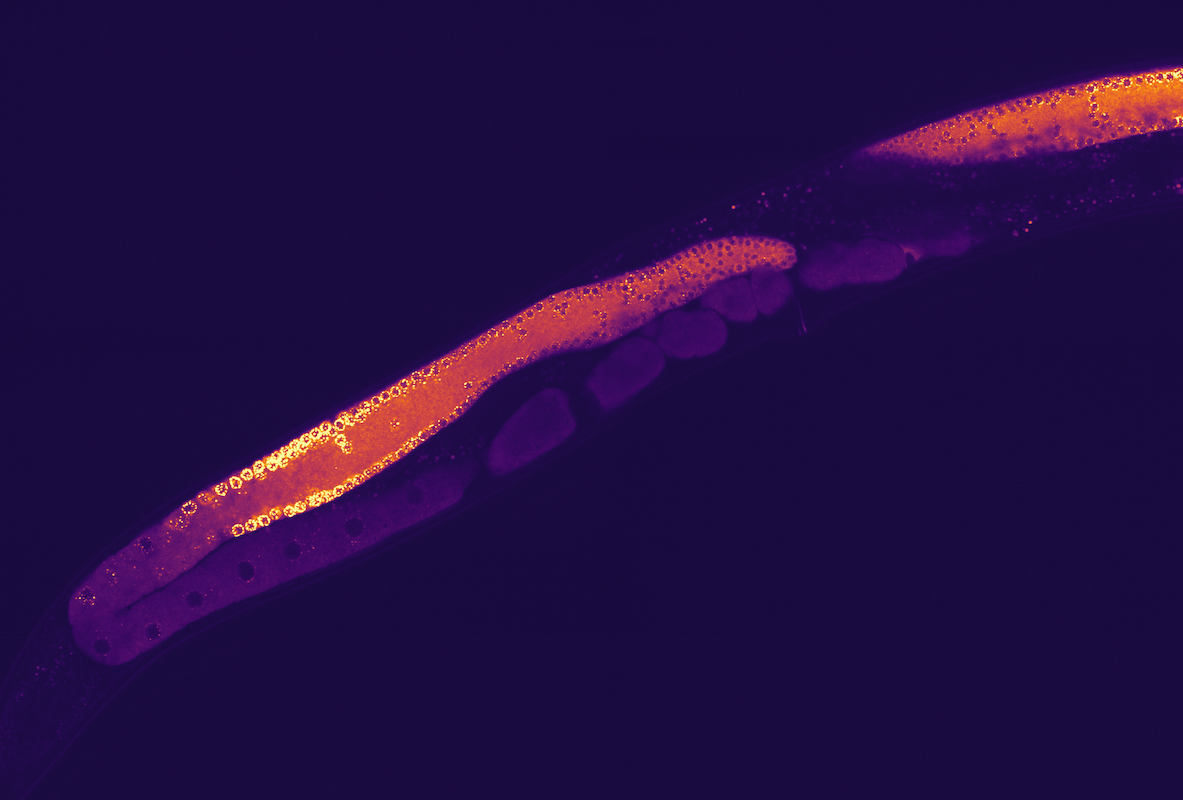
(1) Den einen Millimeter langen Fadenwurm C. elegans nutzen Forschende gern als Modellsystem, um die Funktion und das Verhalten von membranlosen Kondensaten innerhalb eines Organismus zu untersuchen. 2009 hatten Hyman und Kolleg:innen nachgewiesen, dass P-Granula – ein für die Fortpflanzung wichtiges Gemisch aus RNA und Proteinen in einzelligen Embryonen (roter Kreis) dieses Wurms – keine Membran besitzen und sich wie flüssige Kondensate verhalten. Kurz vor der asymmetrischen Zellteilung der Embryonen sammeln sich die P-Granula-Kondensate in einer der beiden entstehenden Tochterzellen.
(2) Die Bildsequenz zeigt den zeitlichen Ablauf der Abscheidung von P-Granula-Kondensaten während der ersten Zellteilung eines C.-elegans-Embryos. Zunächst sind die P-Granula homogen verteilt. Später sammeln sie sich auf einer Seite der Embryonen-Zelle, gefolgt von einer asymmetrischen Zellteilung. Eine wichtige Erkenntnis des Hyman-Teams war, dass dieser Prozess durch Kondensate – und nicht durch direkten Transport – angetrieben wird.
(3) Das Hyman-Team konnte die Kondensatbildung auch im Reagenzglas studieren – hier bei einer gereinigten Proteinlösung, in der sich die Phasentrennung vollzog. Das Kompositbild zeigt eine Wasser.l-Emulsion, die fluoreszierend markierte Kondensate eines P-Granula-Proteins enthält. Solche In-vitro-Studien ermöglichen es dem Team, das Phasentrennungsverhalten in einer kontrollierteren Umgebung zu untersuchen als in einzelligen Wurm-Embryonen.
Wechselwirkung von Biochemie und Physik
Hymans Forschungsansatz ist dementsprechend komplizierter als der traditionelle: Während die Moleküle in den Kondensaten wie üblich biochemisch wechselwirken, unterliegen die Tröpfchen zusätzlich den Gesetzen der Physik. Sie bilden sich durch einen sogenannten Phasenübergang – ähnlich wie Wasser bei Kälte zu Eis wird. Die bis zu hundertfach höhere Proteinkonzentration in den Kondensaten bewirkt, dass deren Dichte zunimmt. Sie verhalten sich dann ähnlich wie Öltropfen in einer Vinaigrette. Öl und Essig lassen sich nicht perfekt vermischen. Lässt man das Dressing stehen, fügen sich die durch die Energie des Rührens getrennten Öltröpfchen nach und nach zu größeren Tropfen zusammen, bis nach ein paar Stunden das gesamte Öl oben schwimmt. Ursache der Öltröpfchenbildung ist, dass Ölmoleküle sich von ihresgleichen besonders stark „angezogen fühlen“. Sie haben eine höhere Affinität zueinander als zu Essigmolekülen. Der Unterschied in den Affinitäten treibt die Phasentrennung voran.
Eine ähnliche Beobachtung führte 2009 zur Entdeckung der Kondensate. Der Physiker Clifford Brangwynne, damals in Hymans Team am Dresdner Max-Planck-Institut, untersuchte einzellige Embryonen des Fadenwurms Caenorhabditis elegans. In deren Zellflüssigkeit bilden sich vor der ersten Teilung sogenannte P-Granula – nach damaliger Lehrmeinung dichte Klumpen aus Proteinen und RNA. Brangwynne stellte jedoch fest, dass sich diese P-Granula eher wie dünnflüssiger Honig verhielten. Sie fügten sich zusammen und trennten sich teils auch wieder – ähnlich wie waberndes Wachs in den Lava-Lampen der 1970er Jahre. Erst kurz vor der asymmetrischen Teilung der Eizelle schieden sich die P-Granula an einer Seite als dichtere Masse ab. Brangwynne und Hyman schlossen daraus, dass P-Granula Flüssigkeiten sind – und als Kondensate einen grundlegend neuen Zustand biologischer Materie repräsentieren. Tatsächlich fanden sie solche Kondensate bald auch in vielen anderen Organismen.
Hyman und sein interdisziplinäres Team entwickelten in der Folgezeit ein ganzes Arsenal an Methoden, um Kondensate zu beobachten und ihre Funktion besser zu verstehen. „Wir kombinieren Konzepte der Molekularbiologie, der physikalischen Chemie und der Physik der weichen Materie“, erklärt der Preisträger. Der fachübergreifende Ansatz ist schon von der Terminologie her eine Herausforderung. Die Wissenschaftsbereiche haben jeweils eigene Sprachen. Manchmal verwenden sie unterschiedliche Formulierungen, um das Gleiche auszudrücken, und manchmal verwenden sie gleiche Formulierungen für Unterschiedliches. „Es ist ein schwieriges, aber faszinierendes Problem“, sagt Hyman. „Unser Ziel ist, kollektive Eigenschaften von Flüssigkeiten – wie Viskosität und Oberflächenspannung – mit der Interaktion individueller Moleküle in Verbindung zu bringen.“
Hyman bezeichnet die Kondensate auch als komplexe Flüssigkeiten: „Es beginnt damit, dass Proteine in der Zellflüssigkeit frei herumdiffundieren. Dann gibt es ein Signal, das die Phasentrennung anregt. Nun separieren sich die Proteine aus dem wässrigen Medium und bilden eine eigene Flüssigkeit.“ Zudem müssen die chemisch-physikalischen Bedingungen stimmen: Ob sich Kondensate bilden, hängt unter anderem vom pH-Wert (Säuregrad), dem Salzgehalt und der Temperatur ab.

„Die medizinische Forschung ist sich weitgehend einig, dass es oft an fundamentalem Verständnis für die Ursachen von Krankheiten fehlt.“
Anthony Hyman
Arbeitsteilung in der Zelle trieb die Evolution voran
Warum bilden sich in Zellen überhaupt Kondensate, wie entstehen sie und welche Aufgaben erfüllen sie? Um dies zu verstehen, ist ein Exkurs in die Frühgeschichte der Evolution erforderlich: Im Urmeer entstanden vor etwa 3,7 Milliarden Jahren die ersten Lebewesen – gemäß klassischem Verständnis einzellige Organismen, die Bakterien ähneln. Diese „Prokaryoten“ besaßen bereits eine äußere Zellhülle, aber noch keinen eigenen Zellkern. Erst später entstand im Zuge der Evolution – vermutlich durch symbiotische Verschmelzung zweier (oder mehr) dieser Urzellen – komplexere Zellen mit eigenem Zellkern, die Eukaryoten. Eukaryotische Zellen finden sich in allen Pflanzen und Tieren.
Der in Eukaryoten entstandene Zellkern bildet eine neue „Unterabteilung“ (Kompartiment) in der Zelle. Er ist mit einer eigenen Membran umschlossen, so dass die Vorgänge in seinem Innern, etwa die Ablesung von DNA, geschützt ablaufen und nicht von anderen Prozessen im Zytoplasma gestört werden. Auch viele Zellorganellen verfügen über eigene äußere Membranen, beispielsweise die Mitochondrien – die „Kraftwerke“ der Zelle.
Auf diese Weise entstand in den Zellen eine räumliche Arbeitsteilung ähnlich wie in Hymans Dorfmodell, in dem die Bewohner:innen jeweils unterschiedlichen Tätigkeiten nachgehen. Ohne diese Arbeitsteilung hätten sich komplexere Organismen („Vielzeller“ wie Tier und Mensch) in der Evolution überhaupt nicht entwickeln können. Eukaryotische Zellen leisten mehr, können mehr Aufgaben gleichzeitig erledigen, und Stoffwechselreaktionen beschleunigen sich.
Ein hohes Reaktionstempo ist beispielsweise wichtig, wenn Zellen vor Umweltstress wie plötzlichem Entzug von Nährstoffen oder fallenden Temperaturen geschützt werden sollen. Die Kondensatbildungen können dann zu einem „Herunterfahren“ der gesamten Zellaktivität führen. Für die Zellen ist das ein Überlebensmechanismus, sie überleben den Stress in verfestigtem Zustand.
Die wichtigste Fähigkeit der Kondensate: hohe Reaktionsgeschwindigkeit
Kondensate ergänzen diese Vielfalt – um einen lebenswichtigen „Express-Service“. Während Organellen wie die Mitochondrien permanent vorhanden sind und arbeiten, bilden sich Kondensate in der Regel „spontan“ bei Bedarf. Dies geschieht bei Schocks teils in Sekundenschnelle. Und wenn sie ihre jeweilige Aufgabe erledigt haben, werden sie meist auch schnell wieder abgebaut. Kondensate haben keine eigene äußere Membran, um sich von der Zellumgebung zu isolieren. Sie nutzen stattdessen die Phasentrennung.
Wichtigstes „Trennwerkzeug“ ist dabei die Oberflächenspannung, die sich zwischen den Kondensaten und der Zellflüssigkeit einstellt. Die Wirkung lässt sich anhand eines Wasserteiches erklären: Die Oberflächenspannung des Wassers sorgt dafür, dass Wasserflöhe über die Oberfläche des Teiches laufen können, ohne zu versinken. Es scheint, als hätte der Teich eine Haut. In ähnlicher Weise wirkt die „Haut“ der Kondensate als eine Art provisorische Membran.
Kondensate fungieren somit als spontan entstehende biochemische „Mini-Labore“. Wegen der räumlichen Abgrenzung von der Umgebung können sich in ihnen sehr schnell hohe Proteinkonzentrationen ansammeln, die manche biochemischen Reaktionen überhaupt erst möglich machen oder beschleunigen. Darüber hinaus können Kondensate Reaktionen in ihrer Zellumgebung verlangsamen, eben weil sie dieser die reaktiven Proteine entziehen. Das Konzentrationsgefälle bleibt wegen der Phasentrennung erhalten.
Zellen im Winterschlaf
Ein hohes Reaktionstempo ist beispielweise wichtig, wenn Zellen vor Umweltstress wie plötzlichem Entzug von Nährstoffen oder fallenden Temperaturen geschützt werden sollen. Die Kondensatbildungen können dann zu einem „Herunterfahren“ der gesamten Zellaktivität führen. Für die Zellen ist das ein Überlebensmechanismus, sie überleben den Stress in verfestigtem Zustand. „Die Zellen gehen dann in einen anderen Materialzustand über und werden starr“, sagt Simon Alberti, bis 2018 Forschungsgruppenleiter am Max-Planck-Institut und seitdem Professor für Zelluläre Biochemie an der Technischen Universität Dresden. „Dies bewahrt die Zellen vor Schäden. In der Regel ist es ein temporäres Abschalten für die spätere Wiederverwendung. Ähnliche Mechanismen spielen womöglich auch bei winterschlafenden Säugetieren wie Bären eine Rolle.“ Getestet sei das aber noch nicht. Hefezellen und Amöben, denen Albertis Max-Planck-Team Nährstoffe entzog, bildeten eine Gel-artige Masse, und das Milieu versauerte. Eine Verfestigung dieser Zellen konnte das Team auch künstlich (ohne Nahrungsentzug) herbeiführen, indem es den pH-Wert der Lösung absenkte.
Normalerweise laufen viele Steuerungsmechanismen in Zellen auf genetischer Ebene ab – mittels sogenannter regulativer Proteine. Oft müssen diese Eiweiße bei Bedarf eigens erzeugt werden. Dazu werden Signale in den Zellkern gesandt, die dort eine DNA-Ablesung in die Wege leiten. Die entstehende mRNA muss zurück ins Zytoplasma transportiert werden, wo dann endlich in einem der Ribosomen (den „Proteinfabriken“ der Zellen) das benötigte Eiweiß erzeugt wird. Das kostet relativ viel Zeit – und dauert für spontane Reaktionen in vielen Fällen zu lange. Kondensate hingegen bilden sich binnen Sekunden.

Abscheidungen aus Kondensaten machen krank
Die größten Durchbrüche verspricht die Kondensatforschung im Bereich der Medizin. Viele degenerative Krankheiten werden verursacht, weil Proteine eine falsche Struktur annehmen und sich dadurch irreversibel verfestigen. Bei Alzheimer führt dies zu den für die Krankheit typischen Ablagerungen. In der Folge sterben Hirnnervenzellen ab, und das Gehirn kann um bis zu 20 Prozent schrumpfen. Alzheimer ist die häufigste Form von Demenz; jede:r fünfte über 80-jährige ist von Alzheimer betroffen, und eine Heilung ist bislang nicht in Sicht. Ein weiteres Beispiel ist die ebenfalls unheilbare Amyotrophe Lateralsklerose (ALS), eine chronisch fortschreitende degenerative Erkrankung des Nervensystems. Ausgelöst wird ALS von Ablagerungen, die sich vor allem in motorischen Nervenzellen bilden. Dies führt zu fortschreitendem Muskelschwund in Armen und Beinen, Sprech- und Schluckstörungen sowie Atemproblemen. Ein prominenter ALS-Patient war der 2018 verstorbene britische Astrophysiker Stephen Hawking.
Oft treten solche toxischen Ablagerungen auf, weil sich Proteine im Alter krankhaft verändert haben. Hyman und sein Team haben eingehend das Protein FUS untersucht, dessen mutierte Formen höchstwahrscheinlich ALS auslösen. „Die genaue Funktion von FUS kennen wir noch nicht“, sagt Hyman. „FUS ist im Zellkern lokalisiert und hat etwas mit DNA-Reparatur zu tun.“ FUS bildet in gesunden Zellen normalerweise flüssige Phasen, nimmt aber bei ALS-Erkrankten festere bis feste Formen an. Wenn Proteine zu Gelen oder Kristallen erstarren, kommen die chemischen Reaktionen in ihnen zum Erliegen. Dann sinken die Chancen, dass sie sich erneut in die flüssige Phase zurückformen. Bei krankhaft veränderten FUS-Proteinen bleiben die Ablagerungen dann oft permanent erhalten.
Bei Alzheimer ist das hauptsächlich in Nervenzellen vorkommende TAU-Protein an der Krankheitsentstehung beteiligt; es bildet die für Alzheimer typischen Amyloid-Abscheidungen. „Wir haben TAU-Proteine im Reagenzglas untersucht und gesehen, dass sich die flüssige Phase nach einigen Stunden in eine feste Form umwandelt“, berichtet Hyman. „Wir haben uns auch eine Variante mit krankhaft veränderter Aminosäure-Sequenz angesehen, und bei der ging dieser Phasenübergang schneller als bei der normalen Variante. Es könnte also sein, dass viele neurodegenerative Erkrankungen durch Proteine ausgelöst werden, die in der normalen Physiologie der Zelle gar nicht so eine große Rolle spielen, aber Probleme bereiten, wenn sie sich falsch organisieren.“
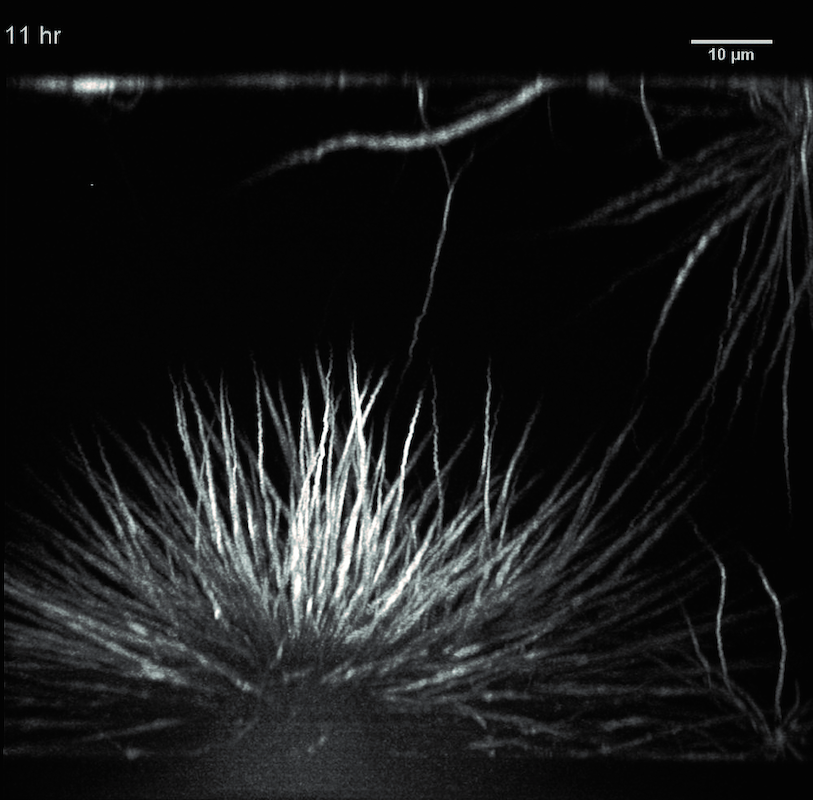
Zeitreihe eines Proteinkondensates beim Übergang von flüssig zu fest. Das Protein FUS (Fused in Sarcoma) steht im Zusammenhang mit neurodegenerativen Krankheiten.
Neuartige Therapien für neurodegenerative Erkrankungen
Hyman hat möglicherweise ein Schlüsselmolekül entdeckt, das gebildete Kondensate wieder aufzulösen vermag. Es handelt sich um Adenosintriphosphat (ATP). Dieses Molekül wird von den Mitochondrien ausgeschüttet und liefert lebenden Zellen den größten Teil der von ihnen benötigten Energie. Mitarbeiter:innen aus Hymans Dresdner Max-Planck-Team hatten ATP zu Proteinkondensaten gegeben und festgestellt, dass die Kondensate daraufhin verschwanden. Dies gelang selbst dann, wenn die Proteinkonzentrationen in den Kondensaten sehr hoch waren. Interessant ist diese Entdeckung vor allem deshalb, weil „die ATP-Produktion im Alter aufgrund von Fehlfunktionen der Mitochondrien abnehmen kann“, so Hyman. „Womöglich lässt sich die Modulation des ATP-Spiegels nutzen, um degenerative Alterskrankheiten, die mit toxischen Kondensaten einhergehen, zu lindern.“
„In den meisten Fällen wissen wir noch immer nicht genau, was die Bildung der Kondensate antreibt und welche Funktion sie haben“, sagt Hyman. „Das Problem ist, dass bei strukturellen Studien auch die Dynamik der Proteinbildung und Wechselwirkungen betrachtet werden müssen.“ In den nächsten fünf Jahren erwartet Hyman jedoch „große Fortschritte im Verständnis“. Er hat sich unter anderem zum Ziel gesetzt, die „molekulare Grammatik“ der Kondensate zu entschlüsseln – das heißt die Aminosäure-Codes aufzuspüren, die biophysikalisches Verhalten von Proteinen beeinflussen: „Bereits heute wissen wir, dass die Aminosäure Glycin dafür sorgt, Kondensate flüssig zu halten, während die Aminosäuren Glutamin und Serin eine Verfestigung vorantreiben.“
Mit den Mitteln des Körber-Preises will Hyman seine Untersuchungsmethoden künftig noch weiter verfeinern. Eine der großen Herausforderungen ist, die Bildung von Kondensaten in Echtzeit zu verfolgen. Der Preisträger ist überzeugt, „dass das zellbiologische Verständnis der Kondensatbildung einen wichtigen Einfluss auf die zukünftige Medikamentenentwicklung haben wird”. Deshalb ist Hyman auch Mitgründer der Bostoner/Dresdener Firma Dewpoint Therapeutics, die unter anderem die Wirkung von Medikamenten auf Kondensate erforscht. Vordringlich arbeitet die Firma daran, die Bildung krankheitsauslösender Ablagerungen mit geeigneten Arzneien zu verhindern. Untersucht werden soll auch, inwieweit eine große Zahl an Kondensaten in einer Zelle die Wirkung existierender Medikamente beeinträchtigt. „Die medizinische Forschung ist sich weitgehend einig“, so Hyman, „dass es oft an fundamentalem Verständnis für die Ursachen von Krankheiten fehlt.“

Kondensate – die Urform allen Lebens auf der Erde?
Auch auf die Entstehung des Lebens auf unserem Planeten wirft die Kondensatforschung neues Licht. Forschende am Max-Planck-Institut für molekulare Zellbiologie und Genetik und am Max-Planck-Institut für Physik komplexer Systeme sind zu dem Ergebnis gekommen, dass sich die allerersten lebenden Organismen im Urmeer nicht in Form von Zellen, sondern in Form von Kondensaten gebildet haben könnten. Kondensate waren demnach Vorläufer der prokaryotischen Urzellen. Die Max-Planck-Teams haben experimentell herausgefunden, dass Kondensate in der Lage sind, sich wie Zellen zu teilen. Dabei haben sie offenbar auch die Eigenschaft erlangt, Erbinformation weiterzugeben. Erst später hätten die Tröpfchen äußere Membranen gebildet und damit die Gestalt der ersten Urzellen angenommen.
Makromoleküle sind im Urmeer vermutlich ständig entstanden. Als sie in der Lage waren, Phasentrennungen durchzuführen, nahmen sie die Gestalt von Kondensat-Tröpfchen an, die sich gegenseitig anzogen und vereinigten. „In diesen Tröpfchen könnten biochemische Reaktionen abgelaufen sein, die außerhalb nicht möglich waren, weil im Urmeer die Konzentrationen nicht hoch genug waren“, sagt Hyman. „Wenn dies zutrifft, sind Kondensate Relikte aus der Urzeit, die sich bis heute in den Zellen erhalten haben – ähnlich wie Fliegen in Bernstein.“
Der Körber-Preisträger 2022

Anthony A. Hyman wurde 1962 in Haifa geboren. Sein Vater, ein britischer Computeringenieur, war beruflich in Israel tätig. Seine Mutter arbeitete als Kunstmalerin. Die Familie zog nach England zurück, als Anthony noch im Kleinkindalter war. „Ich war ein sehr verträumtes Kind und hatte nie über eine Karriere nachgedacht, außer einer als Fahrradmechaniker.“ Auch in seiner Schulzeit deutete noch nichts auf Hymans Genie hin: „Ich hatte schlechte Noten und schnitt in Prüfungen nie gut ab.“ Nach dem Schulabschluss trat Hyman eine Stelle als Laborgehilfe am University College London (UCL) an, wo er unter anderem Zellkulturen für wissenschaftliche Untersuchungen vorbereitete. Die Arbeit faszinierte ihn, und bald nahm er auf Empfehlung des Biologen Terry Preston eigene kleine Experimente vor. Zuweilen saß er bis Mitternacht im Labor. Preston riet ihm, Biologie zu studieren.
Hyman studierte am UCL, das zur Universität Cambridge gehört, Zoologie und spezialisierte sich auf Zellbiologie. 1988 promovierte er am King’s College über embryonale Zellteilungen des Fadenwurms Caenorhabditis elegans. Nach seiner Promotion ging Hyman für fünf Jahre an die University of California in San Francisco, USA, wo er sich mit inneren Zellstrukturen (Mikrotubuli) befasste. 1993 wurde Hyman Gruppenleiter am Europäischen Laboratorium für Molekularbiologie in Heidelberg. Großen Einfluss übte dort der französische Zell- und Molekularbiologe Eric Karsenti auf ihn aus: „Karsenti war überzeugt, dass man die dynamischen Vorgänge in einer Zelle nur mit Hilfe der Physik verstehen kann.“
1999 war Hyman eines der Gründungsmitglieder des Max-Planck-Instituts für molekulare Zellbiologie und Genetik in Dresden, das er bis heute gemeinsam mit einem Direktor:innenteam leitet. Seit 2007 ist er Fellow der britischen Royal Society, seit 2020 internationales Mitglied der amerikanischen National Academy of Sciences sowie seit 2021 Mitglied der Nationalen Akademie der Wissenschaften Leopoldina.
2009 entdeckten Hyman und sein Team die Kondensate – winzige Tröpfchen in der Zellflüssigkeit, die als „Mini-Labore“ spontane biochemische Reaktionen ermöglichen. Kondensate sind ein völlig neuer Materialzustand belebter Materie und unterliegen unter anderem den Gesetzen der Biophysik.
Hyman war verheiratet mit der amerikanischen Mikrobiologin Suzanne Eaton (1959–2019), mit der er zwei Söhne hat. In seiner Freizeit fährt er gerne Fahrrad und spielt „wann immer ich Zeit habe Querflöte, meist klassische Musik und am liebsten Bach“.
Interview mit Tatjana König, Vorständin der Körber-Stiftung
Tatjana König über den Körber-Preis

„Andererseits ist es nun gerade wichtig, eine europäische Wissenschaft zu stärken, die auf dem Fundament der Freiheit und Demokratie steht.“
Tatjana König
Ehem. Vorständin der Körber-Stiftung
Warum vergibt die Körber-Stiftung einen europäischen Preis statt einer nationalen oder weltweiten Auszeichnung?
Die europäische Verständigung und Einigung war schon 1985 das zentrale Anliegen Kurt A. Körbers bei der Stiftung des Preises. Ihm war klar, dass in einer Welt internationaler Konflikte – der Eiserne Vorhang schien damals noch schier unüberwindbar – und nationaler Egoismen ein Preis für ganz Europa, West und Ost, eine besondere symbolische Bedeutung hätte. Die politischen Entwicklungen der vergangenen Jahre und vor allem die Ereignisse seit Anfang des Jahres 2022 zeigen uns deutlich, dass wir an der Mission eines vereinten Europa unbedingt festhalten müssen, und ein Wissenschaftspreis für Europa unterstreicht das.
Bekommt die Idee von der Wissenschaft als völkerverständigendes Element nicht gerade einen massiven Dämpfer versetzt?
Einerseits ja, denn es wird deutlich, auch Wissenschaft operiert nicht in einem politisch neutralen Raum, und wir werden in Zukunft noch genauer hinschauen müssen, welche Wissenschaftskooperationen wir zu welchem Zweck mit wem eingehen wollen und dürfen. Andererseits ist es nun gerade wichtig, eine europäische Wissenschaft zu stärken, die auf dem Fundament der Freiheit und Demokratie steht. Denn nur mit diesem Selbstverständnis wird echte Innovation auf Dauer möglich sein, und vor allem: Nur so werden wir unsere Werte verteidigen können.
Welche Rolle kann der Körber-Preis dabei spielen?
In der Wissenschaft sind Kooperationen unerlässlich. An den europäischen Forschungsinstitutionen arbeiten Wissenschaftlerinnen und Wissenschaftler aus ganz Europa und der Welt, die Forschungsgruppen sind vielfältig und international. Ohne diesen grenzübergreifenden Wissensaustausch würde Europa als Standort für Innovationen und wegweisende wissenschaftliche Erkenntnisse irgendwann abgehängt. Der Körber-Preis fördert daher ganz gezielt die Grundlagenforschung in Europa, um auch in Zukunft im Wettbewerb um die besten Ideen mithalten zu können. Unser Ziel ist, die europäische Wissenschaftscommunity anlässlich der Körber-Preis-Verleihung zusammenzubringen, um die Rahmenbedingungen und Herausforderungen für eine erfolgreiche europäische Wissenschaft auszuloten.
Ein Wort zum diesjährigen Preisträger?
Mit all unseren Preisträgerinnen und Preisträgern können wir hoffentlich zeigen, welchen wichtigen Beitrag Wissenschaft zur Bewältigung der großen Herausforderungen leisten kann, auch und gerade, wenn sie überwiegend noch im Stadium der Grundlagenforschung ist. Anthony Hyman ist wieder ein wunderbares Beispiel dafür. Als britischer Staatsbürger lebt und arbeitet er seit vielen Jahren in Dresden und führt dort ein internationales Team. Seine Entdeckung der Zellkondensate, ein grundlegend neuer Zustand biologischer Materie, ist im Grunde wie das Betreten eines neuen Planeten. Noch wissen wir nicht genau, was wir dort finden werden, aber wir können sicher sein, dass beispielsweise unser Verständnis neurodegenerativer Erkrankungen auf eine neue Basis gestellt werden wird und sich im Idealfall auch gänzlich neue Wege zu ihrer Heilung öffnen.
Preisverleihung 2022

Einlass im Foyer des Hamburger Rathauses vor der feierlichen Preisverleihung Foto: Körber-Stiftung/Claudia Höhne 
Von links: Tatjana König (Vorständin der Körber-Stiftung), Prof. Dr. Martin Stratmann (Präsident der Max-Planck-Gesellschaft), Prof. Dr. Anthony Hyman (Körber-Preisträger 2022), Dr. Peter Tschentscher (Erster Bürgermeister der Freien und Hansestadt Hamburg), Dr. Lothar Dittmer (Vorsitzender des Vorstands der Körber-Stiftung) Foto: Körber-Stiftung/Claudia Höhne 
Dr. Peter Tschentscher begrüßte die Gäste zur Verleihung des Körber-Preises 2022. Foto: Körber-Stiftung/Claudia Höhne 
Zur Preisverleihung waren rund 500 Gäste eingeladen. Foto: Körber-Stiftung/Claudia Höhne 
Dr. Lothar Dittmer ging in seiner Rede auf die Vision des Stifters Kurt A. Körber ein, Wissenschaft auszuzeichnen, die einen wesentlichen Beitrag zur Erhaltung der Lebensbedingungen auf unserem Planeten zu liefern verspricht. Foto: Körber-Stiftung/Claudia Höhne 
Dr. Helen Czerski im Gespräch mit Prof. Dr. Anthony Hyman Foto: Körber-Stiftung/Claudia Höhne 
Dr. Helen Czerski im Gespräch mit Tatjana König und Prof. Dr. Martin Stratmann Foto: Körber-Stiftung/Claudia Höhne 
Die Stipendiaten der Deutschen Stiftung Musikleben, Fabian Egger (Querflöte) und Johann Zhao (Klavier), sorgten für den musikalischen Rahmen. Foto: Körber-Stiftung/Claudia Höhne 
Dr. Lothar Dittmer, Prof. Dr. Anthony Hyman und Prof. Dr. Martin Stratmann nach der Urkundenübergabe Foto: Körber-Stiftung/Claudia Höhne 
Katharina Fegebank (Zweite Bürgermeisterin der Freien und Hansestadt Hamburg) mit dem diesjährigen Preisträger Foto: Körber-Stiftung/Claudia Höhne 
Sektempfang nach der Urkundenübergabe Foto: Körber-Stiftung/Claudia Höhne
Fotos von der Verleihung des Körber-Preis für die Europäische Wissenschaft 2022 an Anthony Hyman im Hamburger Rathaus am 02. September 2022
Die Fotos können im Zusammenhang mit einer Berichterstattung über den Körber-Preis mit dem angegebenen Fotocredit Körber-Stiftung/Claudia Höhne honorarfrei veröffentlicht werden.
Zelltröpfchen als biochemische Mini-Labore