
Foto: Friedrun Reinhold
Botond Roska (2020):
Neues Sehen für Erblindete
Die meisten Seherkrankungen gehen auf erbliche oder altersbedingte Defekte in der Netzhaut (Retina) zurück. Roska und Kolleg:innen haben in einer Pionierarbeit die etwa hundert unterschiedlichen Zelltypen in der Retina aufgespürt und deren komplexes Zusammenspiel bei der Signalverarbeitung ergründet. Dabei gelang es, zahlreiche Netzhauterkrankungen auf genetische Defekte in einzelnen Zellen zurückzuführen. Nun arbeitet der Wissenschaftler daran, diese grundlegenden Einsichten für Patienten fruchtbar zu machen und deren Erkrankungen mit Gentherapien zu lindern oder zu heilen. Einen echten Durchbruch schaffte Roska, als er einen Zelltyp im Auge so umprogrammierte, dass dieser die Funktion von defekten Lichtrezeptor-Zellen übernehmen konnte. Blinde Netzhäute konnte er damit wieder lichtempfindlich machen – und die klinische Erprobung bei blinden Menschen hat bereits begonnen.
Neues Sehen für Erblindete
Text: Claus-Peter Sesín
Fotos: Friedrun Reinhold
Botond Roska zählt zu den weltweit führenden Netzhautforschern. Der gebürtige Ungar hat sich zum Ziel gesetzt, Erblindeten zumindest teilweise das Augenlicht zurückzugeben.
Die meisten Seherkrankungen gehen auf erbliche oder altersbedingte Defekte in der Netzhaut (Retina) zurück. Roska und Kollegen haben Pionierarbeit geleistet, die etwa hundert unterschiedlichen Zelltypen in der Retina aufzuspüren und deren komplizierte Signalverarbeitung zu ergründen. Dabei konnte das Team viele Netzhauterkrankungen auf genetische Defekte in einzelnen Zellen zurückführen. Nun arbeiten die Forscher daran, diese Defekte unter anderem mit Gentherapien zu lindern oder zu heilen. Außerdem gelang es Roska bereits 2008, lichtempfindliche Kanalproteine von Grünalgen mittels Genfähren in Netzhautzellen von blinden Mäusen zu „schleusen“ und den Nagern damit rudimentäres Sehen zu ermöglichen. Eine ähnliche Heilmethode testet das Team derzeit auch an blinden Menschen. Eine Umfrage unter 2000 Amerikanern ergab, dass Erblindung für sie die schlimmste vorstellbare Krankheit ist – noch vor Alzheimer, Krebs oder der Immunschwäche AIDS. Weil Menschen immer älter werden, nehmen Augenerkrankungen stark zu. Weltweit sind 36 Millionen Menschen blind, und über eine Milliarde leiden an erheblicher Sehbehinderung. „Sehen hat für die Menschen nicht zuletzt deshalb eine so hohe Bedeutung, weil in heutiger Zeit ein Großteil des Informationsaustausches über visuelle Geräte wie Handys oder Displays erfolgt.“ Wer schlecht sieht, erleidet daher auch kommunikative Defizite. Gründe genug also für Botond Roska, auf Hilfe für die vielen Betroffenen zu sinnen.
Roska hat zunächst Cello studiert, musste seine Musikerkarriere jedoch wegen einer Handverletzung vorzeitig aufgeben. Anschließend absolvierte er ein Medizin- und Mathematikstudium und forschte als Neurobiologe in den USA. Von 2005 bis 2017 leitete Roska eine Forschungsgruppe am Friedrich Miescher Institut für biomedizinische Forschung in Basel. Seit 2014 ist er Professor an der Universität Basel. Zusammen mit Professor Hendrik Scholl wurde er im Dezember 2017 Gründungsdirektor des Instituts für Molekulare und Klinische Ophthalmologie Basel (IOB).
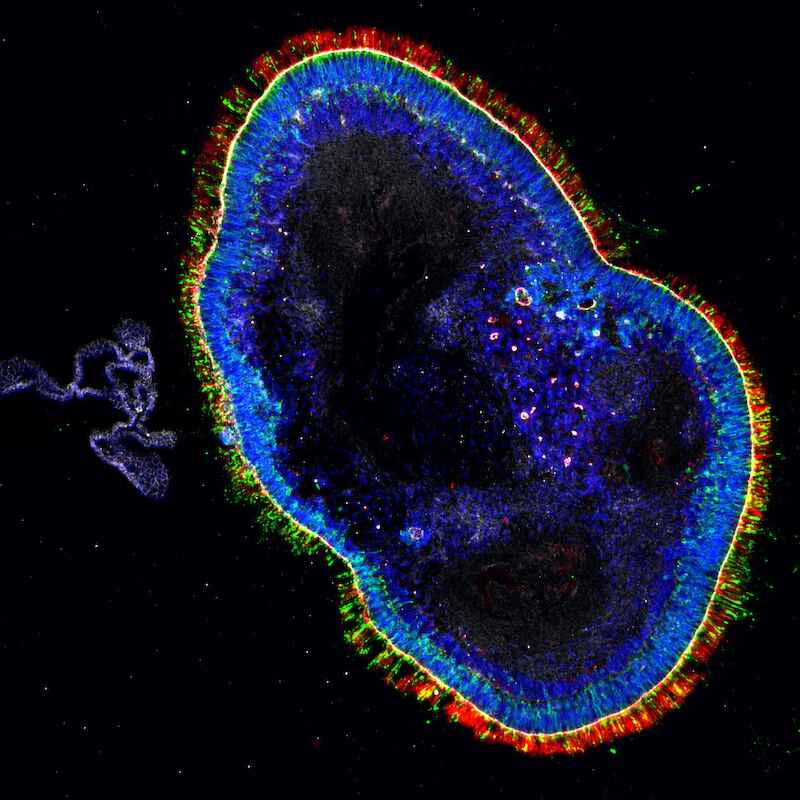
(1) Mini-Netzhaut aus der Petrischale: Das Roska-Team züchtet diese nur etwa zwei mal zwei Millimeter kleinen Retina-Organoide aus pluripotentenStammzellen. Die Photorezeptoren sind rot und grün markiert, die übrigen Zellen blau. 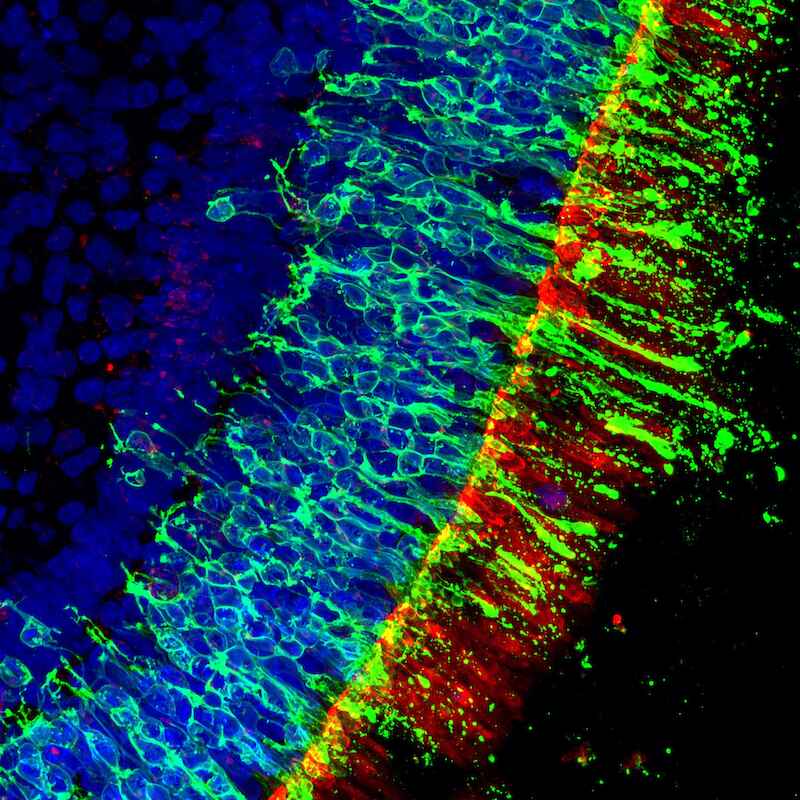
Roskas Forschung revolutioniert die Augenheilkunde
Traditionell hatten Mediziner die Netzhaut des Auges vorwiegend als Gewebe untersucht. Botond Roska hingegen machte sich die Mühe, erstmals intensiv die rund hundert Zelltypen in der Netzhaut und deren funktionelles Zusammenwirken zu studieren. Sein Team lokalisierte und kartierte zudem zahlreiche Gendefekte, die zu Augenleiden führen. Damit haben die Forscher einen Fundus an neuem Wissen geschaffen, der die Augenheilkunde revolutioniert. Lange Zeit verliefen Innovationen in der Augenheilkunde frustrierend langsam. „Das liegt daran“, erklärt Roska, „dass Grundlagenforscher oft die therapeutischen Bedürfnisse in den Kliniken nicht genau genug kennen“ – unter anderem, weil ihnen der unmittelbare Kontakt zu den Patienten fehlt. Die Ärzteteams in den Kliniken hingegen seien meist nur unzureichend über den neuesten Stand der Grundlagenforschung informiert. Um diese Lücke zu schließen, verfolgt das IOB seit 2017 einen interdisziplinären Ansatz, bei dem „Grundlagenforscher und Kliniker täglich Hand in Hand zusammenarbeiten“.
Die Retina befindet sich im hinteren Teil des Augapfels – gegenüber der Augenlinse, die Bilder auf sie projiziert. Ihre lichtempfindlichen Elemente sind sogenannte Stäbchen und Zapfen. Stäbchen sind besonders sensibel und ermöglichen das Sehen im Dunkeln oder bei Nacht. Die Zapfen sorgen für das scharfe und farbige Sehen im Hellen. Stäbchen und Zapfen besitzen lichtempfindliche „Antennen“, die das auftreffende Licht in elektrische Signale umwandeln. Diese Signale werden von den Nervenzellen der Netzhaut aufwendig vorverarbeitet; der „Output“ gelangt über den Sehnerv zu den Sehzentren des Großhirns. „Die Netzhaut ist ein nach außen verlagerter Teil des Gehirns. Ihr komplexes Netzwerk von Nervenzellen verarbeitet die Signale ähnlich wie ein Computer“, sagt Roska.
Ihr komplizierter Aufbau macht die Netzhaut aber auch besonders anfällig. „Die Retina ist von allen Organen des Körpers am stärksten von genetischen Erkrankungen betroffen“, sagt Hendrik Scholl, Direktor des klinischen Forschungszentrums am IOB, mit dem Roska eng zusammenarbeitet.

„Wir führen Grundlagenforschung und Medizin zusammen und entwickeln so neue Behandlungsmethoden. Mit meiner Arbeit möchte ich dazu beitragen, dass blinde Menschen ihre Sehkraft zurückgewinnen.“
Botond Roska
Erste Gentherapien erprobte das Team an Mäusen
Weltweit haben Augenforscher:innen inzwischen Hunderte von genetischen Defekten identifiziert, die zu Netzhauterkrankungen führen. Besondere Aufmerksamkeit widmete Roska der am weitesten verbreiteten genetischen Augenerkrankung – der Retinitis pigmentosa. Sie macht sich früh bemerkbar und beginnt mit Defiziten beim Sehen im Dunkeln, weil die Stäbchen absterben. Später verlieren die Zapfen ihre Lichtempfindlichkeit, und in diesem Stadium erblinden die Betroffenen. Retinitis pigmentosa kann durch Defekte in rund 70 unterschiedlichen Genen ausgelöst werden und gilt bislang als unheilbar. Im Anfangsstadium könnte die Krankheit möglicherweise mit virusbasiertem Genersatz oder Gen-Editierung behandelt werden. Bei bereits vollständig Erblindeten ist das allerdings nicht mehr möglich. Hier setzen Roska und sein Kollege José-Alain Sahel aus Paris jetzt auf eine therapeutische Methode, die ihm bereits 2008 in Mausversuchen gelang. Mittels Genfähren werden lichtempfindliche Protein-Kanäle, die aus Algen, Pilzen oder Bakterien stammen, in noch intakte Zellen der Netzhaut eingebaut. Die so umprogrammierten Zellen übernehmen dann die Aufgabe der Lichtrezeptorzellen und könnten ein zumindest teilweise wiederhergestelltes Sehen ermöglichen. Die Forscher erwarten nun, dass mit einer lichtverstärkenden Brille sich die Betroffenen dann wieder in ihrer Umgebung orientieren können. Hierzu ist eine klinische Studie mit fünf Probanden bereits im Gange.

Für das scharfe Sehen sorgt der „Gelbe Fleck“
Die altersbedingte Makuladegeneration (AMD) ist eine ebenfalls verbreitete Erkrankung der Photorezeptoren. Betroffen ist nur die zentrale Region der Netzhaut, die sogenannte Makula oder Fovea, die das scharfe Sehen ermöglicht, wie etwa zum Lesen oder zum Erkennen von Gesichtern. Das Team von Botond Roska hat vor kurzem eine Technologie entwickelt, die es künftig ermöglichen könnte, die Sehfunktion der degenerierten Fovea von AMD-Patienten wiederherzustellen. Die Forscher sensibilisierten dazu menschliche Netzhautzellen für infrarotes Licht, das mit Hilfe einer Spezialbrille auf die Fovea projiziert werden kann.
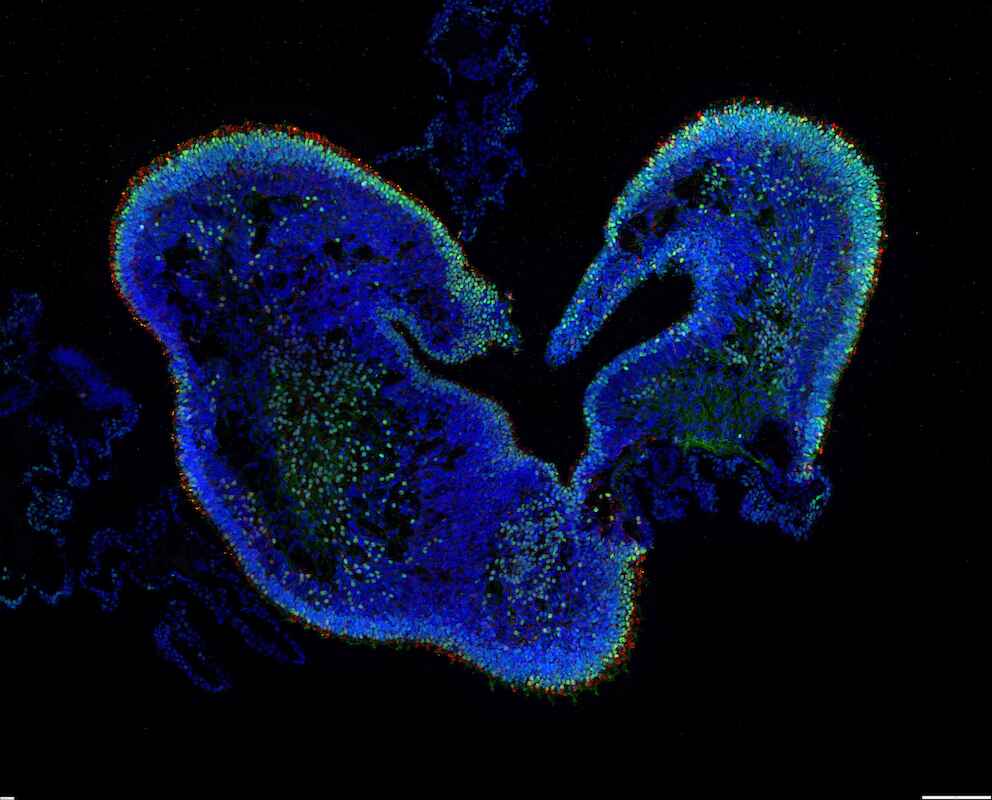
Roskas jüngster Durchbruch ist ein wichtiges Hilfsmittel, um Ergebnisse der Grundlagenforschung in die therapeutische Praxis umzusetzen: Gemeinsam mit seinen Kollegen gelang es ihm, künstliche Netzhäute in Petrischalen zu züchten, die eine ähnliche Zelltypenvielfalt und Schichtenstruktur aufweisen wie eine normale Netzhaut. Das Team nutzt dazu ein gentechnisches Standardverfahren, um adulte Zellen in sogenannte induzierte pluripotente Stammzellen „umzuprogrammieren“. Zum Züchten der künstlichen Netzhaut entnimmt das Roska-Team dem Patienten zunächst eine Hautprobe, aus der dann mit obiger Methode induzierte pluripotente Stammzellen erzeugt werden. Diese Zellen lassen die Forscher dann sozusagen ein zweites Mal den vorgeburtlichen Differenzierungsprozess durchlaufen – allerdings nicht im Mutterleib, sondern in einer Petrischale mit einer speziell abgestimmten Nährlösung. Nach etwa 30 Wochen – so lange dauert es auch im Uterus – differenzieren die pluripotenten Stammzellen zu sogenannten Netzhaut-Organoiden.
Diese etwa zwei mal zwei Millimeter kleinen Gebilde enthalten ähnliche Zelltypen mit denselben oder verwandten Funktionen wie die ausgewachsene Netzhaut. Weist der Patient, dem die Hautprobe entnommen wurde, Gendefekte in der Retina auf, so finden sich diese Defekte auch in den künstlich gezüchteten Organoiden. An diesen Mini-Netzhäuten können die Mediziner nun testen, ob bestimmte Gentherapien funktionieren, und dabei unterschiedliche Ansätze ausprobieren.

Viren bringen neues Genmaterial in Zellen
Viren sind ideale Vehikel zum Transport von Genmaterial, denn sie übertragen von Natur aus bei jeder Infektion ihre eigene Erbsubstanz. Viren bestehen aus einem kurzen Stück RNA oder DNA, das meist von einer schützenden äußeren Hülle umgeben ist. Um eine Wirtszelle (vom Menschen oder von Tieren) zu infizieren, dockt das Virus mit seiner Hülle an einen passenden Rezeptor auf der Oberfläche dieser Wirtszelle an. Dadurch kann das Virus in die Wirtszelle eindringen. Im Innern löst sich seine Schutzhülle auf. Das nun frei liegende Virusgenom programmiert die Wirtszelle so um, dass diese immer neue Viren herstellt.
Der Trick der Gentherapeuten besteht darin, das Virus gleichsam zu entkernen: Sie entfernen das ursprüngliche Virusgenom ganz oder teilweise und befüllen die leere Virushülle beispielsweise mit einem menschlichen Gen. Dieses für das Virus fremde Gen wird auch Transgen genannt. Trotz dieses extremen Eingriffs ist das Virus immer noch in der Lage, Wirtszellen zu infizieren, da die Eigenschaften seiner Hülle erhalten bleiben. Der Unterschied ist, dass das Virus nach dem Andocken und Eindringen nun statt seines eigenen Genoms das Transgen in die Wirtszelle einbringt. Dieses Transgen kann Gendefekte der Zelle reparieren oder kompensieren.
Gentherapie verhalf blinden Mäusen zu neuem Sehen
Bei seinen Mausversuchen im Jahr 2008 baute Roska die aus Grünalgen stammenden lichtempfindlichen Kanalproteine mit Viren-Hilfe in eine der beiden Bipolar-Zellgruppen ein. Damit wurden diese Bipolarzellen aus der mittleren Netzhautschicht gleichsam zu künstlichen Photorezeptoren. Sie ersetzten die Stäbchen und Zapfen, die bei den blinden Mäusen abgestorben waren. Mit diesen künstlichen Zellen reagierten die Mäuse wieder auf einfache visuelle Reize: Sie suchten beispielsweise Deckung, wenn sie starkem Licht ausgesetzt wurden, und bewegten den Kopf in Richtung von Mustern, die ihnen die Forscher zeigten.
In Tierversuchen lassen sich die Grundlagen des Sehens besonders gut ergründen. Bei Experimenten mit Kaninchen hat Roska Ganglienzellen mit sehr feinen Glaspipetten verbunden. Diese Mikropipetten dienen zum einen als Elektroden, um – abhängig von Lichtsignalen, die auf die Netzhaut gelenkt werden – elektrische Aktivität in den Ganglienzellen zu messen. Zum anderen können die Forscher durch diese Pipetten einen Farbstoff injizieren, der sich schnell über die dendritischen Ausläufer verteilte. Auf diese Weise wird die neuronale Vernetzung der jeweiligen Ganglienzellen auch optisch sichtbar. Beim Menschen sind solche Experimente aus ethischen Gründen untersagt.
Dank der Netzhäute von Organspendern konnten Roska und Kollegen jedoch wichtige Erkenntnisse gewinnen. 2018 gelang es dem Team, „die gespendete Retina eines Verstorbenen in unglaublich gutem Zustand zu halten, sodass sie einen ganzen Tag lang auf Licht reagierte“, berichtet Magdalena Renner, die bei Roska die Organoid-Gruppe leitet.
Viren für die Gentherapie
Für die Gentherapie nutzt Roskas Team sogenannte Adeno-assoziierte Viren (AAV), die sich in Bioreaktoren künstlich herstellen lassen. Diese Viren sind für den Menschen ungefährlich. Sie können sich in der Zelle auch nicht eigenständig vermehren. Im Jahr 2019 veröffentlichte das Team eine Bibliothek von 230 unterschiedlichen AAV – mehrere davon könnten für die Therapie eines bestimmten Zelltyps der Netzhaut verwendet werden, der von einer genetischen Erkrankung betroffen ist. Das Roska-Team gestaltet die Transgene in den Viren so, dass sie möglichst vielen Patienten helfen. Ob ein universeller Einsatz möglich ist, hängt allerdings auch von der Art der jeweiligen Therapie ab: Bringt das Virus eine fehlerfreie Version des Gens in die Zelle ein, kann damit einer ganzen Reihe von Patienten mit Mutationen in diesem Gen geholfen werden – unabhängig davon, wo genau sich die Mutation im einzelnen Fall befindet. Wichtig ist nur, dass der Gendefekt auch tatsächlich in genau diesem Gen vorliegt. Anders ist die Lage, wenn Viren eingesetzt werden, die eine spezielle Reparaturmaschinerie in sich tragen. Diese helfen dann nur Patienten, die genau diese Mutation aufweisen. Beide Therapieansätze lassen sich zuvor mit „In-vitro”-Tests an Organoiden des Patienten überprüfen.

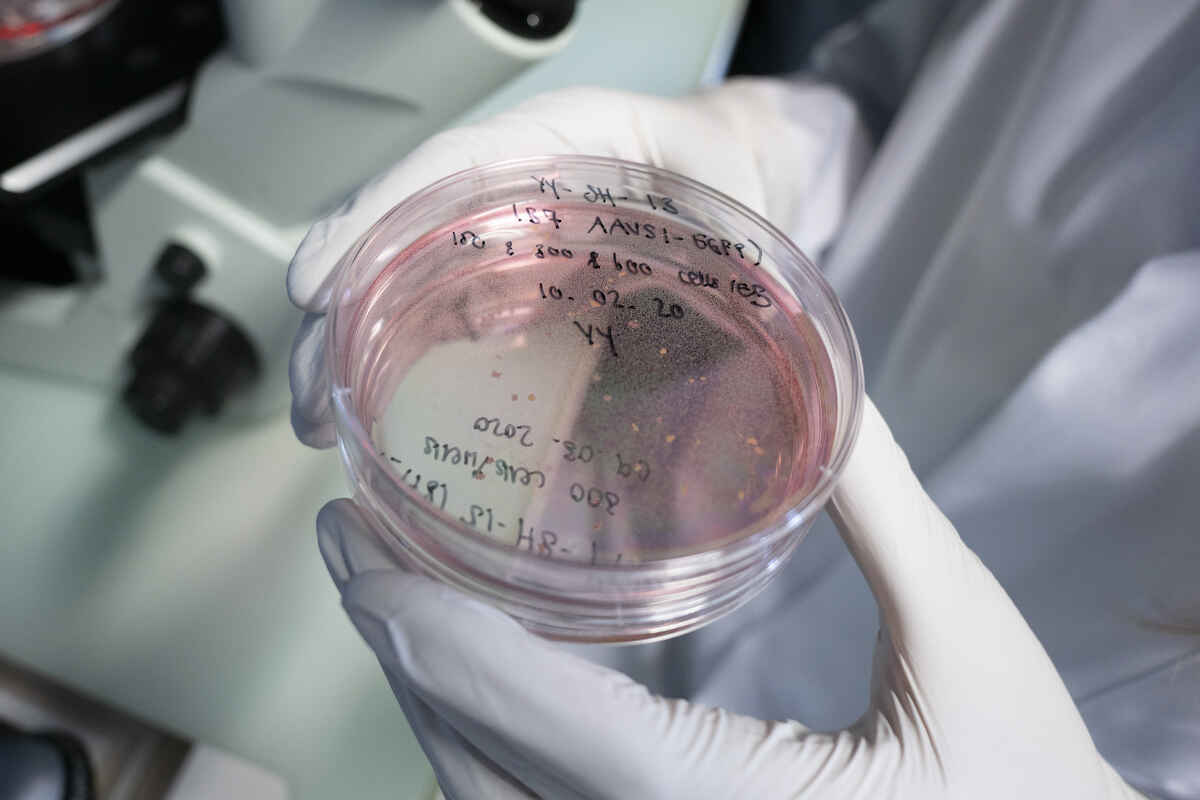
Rot eingefärbte Netzhaut-Organoide in der Petrischale 
Martina De Gennaro bereitet menschliche Netzhaut-Organoide vor.
Der Schwerpunkt liegt auf der Grundlagenforschung
Gentherapien hält Botond Roska für „das nächste große Ding“ in der Medizin. „Augenkrankheiten sind besonders gut für Gentherapien geeignet, weil das Immunsystem im Bereich der Augen nicht sonderlich aktiv ist“, sagt Roska. Deshalb gibt es im Auge auch wenig unerwünschte Reaktionen auf injizierte Medikamente oder Viren. Zwei Drittel seiner Arbeit verbringt Botond Roska mit Grundlagenforschung. „Wir haben uns zur Aufgabe gemacht, die Struktur und Funktion des Auges möglichst genau zu verstehen und den Sehvorgang in unterschiedlichen Stadien der Verarbeitung bis hin zum visuellen Kortex zu untersuchen“, so Roska. Der Ansatz des Teams ist interdisziplinär und kombiniert Genetik, Virologie, Molekularbiologie, Organoid-Forschung, Elektrophysiologie, Zwei-Photonen-Bildgebung und Computermodelle.
Erste grundlegende Erkenntnisse zur Struktur der Netzhaut gewannen Roska und Kollegen bei Tierversuchen. Die Netzhaut besteht aus fünf Schichten: Drei enthalten Zellkörper von Nervenzellen, die beiden dazwischenliegenden dienen der neuronalen Signalverarbeitung und der Kommunikation zwischen den Schichten. Die Schicht mit den lichtempfindlichen Stäbchen und Zapfen ist erstaunlicherweise am weitesten von der Augenlinse entfernt, es ist gleichsam die hinterste Schicht der Netzhaut. Das beeinträchtigt jedoch das Sehvermögen nicht, weil alle fünf Netzhautschichten – also auch die vier davorliegenden – weitgehend transparent sind. In der mittleren Netzhautschicht befinden sich unter anderem zwei Haupttypen von Bipolarzellen, die elektrische Signale, die sie von den Stäbchen und Zapfen erhalten, verstärken oder hemmen können. Die Bipolarzellen leiten ihren neuronalen Output an retinale Ganglienzellen weiter, die sich in der vorderen Netzhautschicht befinden, die der Augenlinse am nächsten liegt. Die Ausläufer (Axone) der Ganglienzellen bilden den Sehnerv, der die in der Retina bereits aufwendig vorverarbeiteten visuellen Signale über eine Zwischenstation zum Sehzentrum der Großhirnrinde transportiert. Insgesamt identifizierten die Forscher rund hundert Typen von Nervenzellen, die an der Signalverarbeitung in der Retina beteiligt sind.

„Augenkrankheiten sind besonders gut für Gentherapien geeignet, weil das Immunsystem im Bereich der Augen nicht sonderlich aktiv ist.“
Botond Roska
Experimente mit Retinas von Organspendern
Um die Aktivität von Zellen einer Spender-Retina zu belauschen, wird diese auf einem speziellen Chip (high density multielectrode array) platziert, der dem lichtempfindlichen Chip einer Kamera ähnelt. Die Ganglienzellen der Netzhaut leiten ihre elektrischen Signale nun nicht mehr an das Gehirn, sondern an die Elektroden auf dem Chip weiter. Auf diese Weise kann die Aktivität zahlreicher Ganglienzellen gleichzeitig überwacht werden. Nach spätestens einem Tag verlieren die Stäbchen und Zapfen der Spender-Retinas ihre Aktivität. Dem Roska-Team gelang es jedoch, in diese Netzhäute – ähnlich wie im Mausversuch – mit Hilfe von Viren lichtempfindliche Kanalproteine einzubauen. Damit reagieren die Spender-Retinas bis zu 14 Wochen lang auf Lichtsignale und ermöglichen in dieser Zeit auch weitere aufschlussreiche Experimente. Diese und andere Experimente ermutigten Gensight Biologics, ein in Paris ansässiges Unternehmen, die lichtempfindlichen Proteine in die Netzhaut von Blinden zu transplantieren. „Dies ist eine laufende klinische Studie“, sagt Roska. „Die Ergebnisse werden voraussichtlich Ende 2020 publiziert und sind bis dahin vertraulich.“
Botond Roska hat bei seinen Studien zu den elementaren Grundlagen des Sehens herausgefunden, dass die rund 100 Nervenzell-Typen der Netzhaut in 30 Modulen (circuit modules) zusammenarbeiten: „Diese Module geben das, was wir sehen, gleichsam in 30 unterschiedlichen ,Filmen‘ mit jeweiligen Teilaspekten der Szene wieder.“ Einige dieser Filme zeigen nur die Umrisse von Objekten – ähnlich einer Strichzeichnung. Andere Filme geben Auskunft über Bewegungen im Gesehenen und deren Richtung. Weitere Filme erfassen vorwiegend schattige oder helle Bereiche. Als „Regisseure“ dieser Filme fungieren 30 unterschiedliche Typen von Ganglienzellen in der Netzhaut. Über den Sehnerv gelangen die 30 Filme in die Sehzentren des Großhirns, wo sie dann zum kompletten Film des Gesehenen zusammengesetzt werden. Roska entdeckte zudem in Mausversuchen, dass viele Netzhautzellen multifunktional agieren. Stäbchen etwa arbeiten bei schwachem Licht als Sinneszellen. Fällt indes helles Licht auf die Netzhaut, dann werden die für das Farbsehen zuständigen Zapfen aktiv, und die Stäbchen ändern ihre Funktion: Sie operieren nun als neuronale Zellen, die die Zapfen bei der Signalverarbeitung unterstützen. Der Übergang von einem Zustand in den anderen erfolgt schlagartig.
Kurzsichtigkeit nimmt weltweit zu
Weiterhin untersuchen Roska und andere IOB-Kollegen die Wachstumsregulation des Auges mit dem Ziel, die weltweit stark zunehmende Kurzsichtigkeit einzudämmen. In Deutschland ist etwa ein Viertel aller Erwachsenen kurzsichtig, in Asien teils bereits 90 Prozent aller Jugendlichen. Kurzsichtigkeit entsteht meist schleichend in Jugendjahren, weil der Augapfel durch genetische und Umwelteinflüsse (dazu zählt unter anderem viel Lesen bei Kunstlicht) geringfügig länger wird. Dadurch rückt der Brennpunkt der Augenlinse vor die Retina, und weit entfernte Objekte werden unscharf abgebildet; scharf sehen Kurzsichtige nur noch Objekte in geringem Abstand. Eine Mitursache der zunehmenden Kurzsichtigkeit ist die immer stärkere Verbreitung von Smartphones. Die eigentliche Sorge der IOB-Forscher gilt aber nicht der Kurzsichtigkeit selbst, die sich mit Brillen oder Laserbehandlung leicht kompensieren lässt. Weit bedrohlicher ist das mit zunehmender Myopie deutlich erhöhte Risiko gravierender Augenerkrankungen: Bei stark Kurzsichtigen steigt die Gefahr einer Netzhautablösung, die unbehandelt zu Erblindung führt, um ein Vielfaches. Ebenfalls deutlich erhöht sind die Risiken für grünen Star (Glaukom) oder Makula-Degeneration. „Solche Störungen zählen in demographisch alternden Gesellschaften“, so Botond Roska, „zu den Hauptursachen für Invalidität und Verlust einer eigenständigen Lebensweise.“ Auch künftig also wird Roskas Vision vom Verstehen des Sehens eng an seine Mission, den Betroffenen wirksam zu helfen, gekoppelt bleiben.

„Retina-Organoide enthalten ähnliche Zelltypen mit denselben oder verwandten Funktionen wie die ausgewachsene Netzhaut.“
Botond Roska
Der Körber-Preisträger 2020

Botond Roska wuchs als Sohn einer Musikerin und eines Computerwissenschaftlers in Budapest auf: „Mein Vater weckte schon früh mein Interesse an Mathematik. Er liebte es nachzudenken – genauso wie ich.“ Doch zunächst überwog der musische Einfluss der Mutter: Roska studierte Cello an der Musikakademie in Budapest und übte sechs bis acht Stunden pro Tag, musste jedoch wegen einer Handverletzung seine Musikerkarriere vorzeitig aufgeben.
Anschließend studierte Roska in Budapest Mathematik und Medizin. An der University of California in Berkeley promovierte er in Neurobiologie. Als Junior Fellow der Harvard University vertiefte er seine Studien in Genetik und Virologie. Von 2005 bis 2017 leitete Roska eine Forschungsgruppe am Friedrich Miescher Institut für biomedizinische Forschung in Basel. Seit 2014 ist er Professor an der Universität Basel. Zusammen mit Professor Hendrik Scholl wurde er im Dezember 2017 Gründungsdirektor des Instituts für Molekulare und Klinische Ophthalmologie Basel (IOB).
Obwohl Augenkrankheiten wegen steigender Lebenserwartung weltweit stark zunehmen, gab es in der Augenheilkunde wenig Innovation. Roska revolutionierte die Grundlagen- und die medizinische Forschung, indem er erstmals die rund 100 Zelltypen der Netzhaut, wo die meisten Augenerkrankungen auftreten, detailliert untersuchte.
Dabei entdeckte er unter anderem, welche Zelldefekte bestimmte Krankheiten auslösen. Zur Heilung entwickeln Roska und Scholl nun moderne Gentherapien. Sein Team widmet sich zurzeit schwerpunktmäßig der genetisch bedingten Retinitis pigmentosa.
In der Grundlagenforschung befasst sich Roska mit den elementaren Funktionen des Sehens und verfolgt die Signalwege der Informationen von der Retina bis in die Tiefen des Gehirns. Er wurde bereits in der Vergangenheit mit zahlreichen hochrangigen Wissenschaftspreisen ausgezeichnet.
Roskas Tagesablauf ist streng strukturiert: „Am Morgen denke ich nach, am Nachmittag spreche ich mit Menschen.“ Nach dem Aufstehen löst er zunächst – als „Hirntraining“ – eine Stunde lang mathematische Probleme; danach denkt er konzentriert über seine Forschung nach. In seiner kargen Freizeit spielt der Preisträger immer noch gern Cello oder hört Musik, von Bach über Beethoven bis Chopin.

„Das Motto unserer Stiftung lautet ,Gesellschaft besser machen‘ – und das finde ich bei Botond Roska mustergültig realisiert, denn seine Grundlagenforschung ist konsequent auf das Wohl der Patientinnen und Patienten ausgerichtet.“
Tatjana König
Ehem. Vorständin der Körber-Stiftung
Preisverleihung 2020
Fotos von der Verleihung des Körber-Preises für die Europäische Wissenschaft 2020 an Botond Roska im Hamburger Rathaus. Die Fotos können im Zusammenhang mit einer Berichterstattung über den Körber-Preis mit dem angegebenen Fotocredit honorarfrei veröffentlicht werden.
Neues Sehen für Erblindete





















